Đọc tài liệu sẽ cùng các em trả lời câu hỏi Bài 5: Giới thiệu về liên kết hóa học thuộc Chủ đề 3: Phân tử với tài liệu Giải KHTN lớp 7 Cánh Diều. Nội dung này chắc chắn sẽ giúp các em chuẩn bị bài học trước khi đến lớp tốt nhất.
Câu hỏi mở đầu trang 33 SGK KHTN lớp 7 Cánh Diều
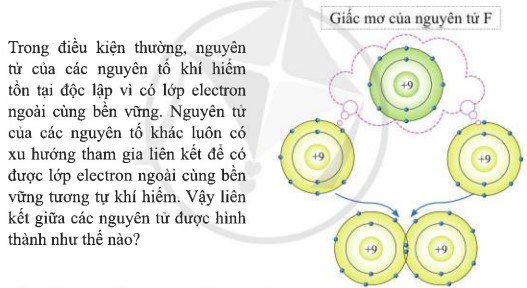
Trả lời
Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy, các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
Nguyên tử của các nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
Câu hỏi 1 trang 33 SGK KHTN lớp 7 Cánh Diều
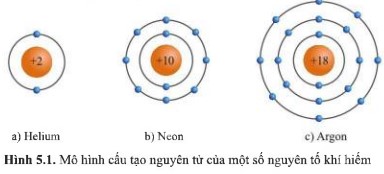
Quan sát hình 5.1, hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm.
Trả lời
- Xét nguyên tử helium: có 2 electron ở lớp ngoài cùng
- Xét nguyên tử neon: có 8 electron ở lớp ngoài cùng
- Xét nguyên tử argon: có 8 electron ở lớp ngoài cùng
Câu hỏi tìm hiểu thêm trang 34 SGK KHTN lớp 7 Cánh Diều
Helium được phát hiện vào năm 1868, khi các nhà khoa học nhận thấy một số nguyên tố chưa được biết đến trong quang phổ ánh sáng từ Mặt Trời. Helium được đặt theo tên của thần Mặt Trời – Helios (theo tiếng Hy Lạp). Tuy nhiên, phải tới năm 1895, các nhà khoa học mới thu được helium trong quá trình xử lí quặng uranium. Mặc dù trong vũ trụ, helium là khí phổ biến thứ hai sau khí hydrogen, nhưng trên Trái Đất khí helium tương đối hiếm. Hãy tìm hiểu một số ứng dụng của helium trong thực tiễn.
Trả lời
Một số ứng dụng của helium trong thực tiễn:
+ Helium được kết hợp với oxygen để giúp cho các bệnh nhân gặp vấn đề về hô hấp có thể thở dễ dàng hơn. Khí này, ở trạng thái lỏng cũng được sử dụng để làm mát nam châm siêu dẫn trong các loại máy chụp cộng hưởng từ. Tránh sinh nhiệt quá cao gây nguy hiểm.
+ Helium nhẹ hơn không khí nên thường được dùng để bơm vào khí cầu hay bóng bay.
+ Helium được sử dụng làm môi trường truyền nhiệt trong lò phản ứng hạt nhân thế hệ mới.
+ Khí helium được sử dụng để phát hiện rò rỉ. Bởi vì helium có kích thước phân tử nhỏ nhất do đó khí helium đi dễ dàng qua những chỗ rò rỉ nhỏ nhất.
+ Helium được dùng để sản xuất chất bán dẫn, sợi cáp quang, sử dụng trong một số ổ đĩa cứng, kính thiên văn,...
Liên kết ion
Câu hỏi 2 trang 34 SGK KHTN lớp 7 Cánh Diều
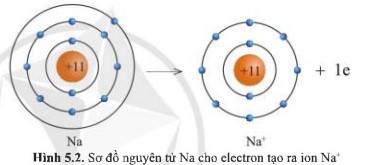
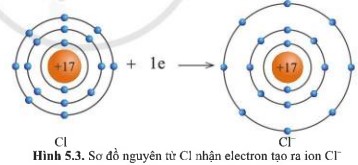
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.
Trả lời
- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn ⟹ Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân ⟹ Có 2 lớp electron
⟹ Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn ⟹ Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân ⟹ Có 3 lớp electron
⟹ Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar
Câu hỏi 3 trang 34 SGK KHTN lớp 7 Cánh Diều
Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+

Trả lời
- Nguyên tử Na có 11 electron và 3 lớp electron
- Ion Na+ có 10 electron và 2 lớp electron
⟹ Nguyên tử Na đã mất đi 1 electron để tạo thành ion Na+
Câu hỏi 4 trang 35 SGK KHTN lớp 7 Cánh Diều
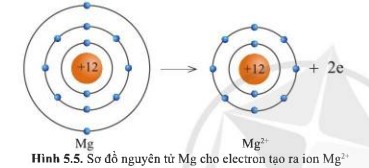
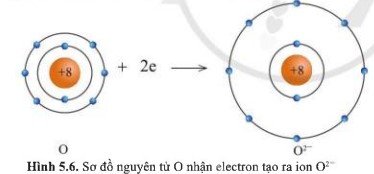
Quan sát các hình 5.5 và 5.6 cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào.
Trả lời
- Ion Mg2+ lớp vỏ có 10 electron tương tự như khí hiếm Neon.
- Ion O2- lớp vỏ có 10 electron tương tự như khí hiếm Neon.
Câu hỏi 5 trang 35 SGK KHTN lớp 7 Cánh Diều
Quan sát hình 5.5, hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+.

Trả lời
- Nguyên tử Mg có 12 electron và 3 lớp electron
- Ion Mg2+ có 10 electron và 2 lớp electron
⟹ Nguyên tử Na đã mất đi 2 electron để tạo thành ion Mg2+
Luyện tập 2 trang 35 SGK KHTN lớp 7 Cánh Diều
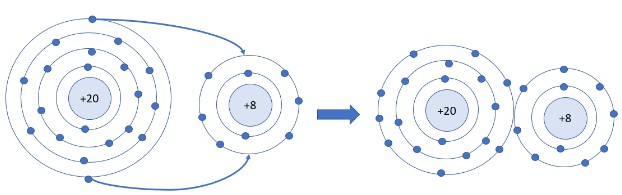
Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide.
Trả lời
Khi Ca kết hợp với O tạo thành phân tử calcium oxide sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử Ca cho đi 2 electron lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Ca2+.
+ Nguyên tử O nhận 2 electron từ nguyên tử Ca tạo thành ion mang điện tích âm kí hiệu là O2-.
Các ion Ca2+ và O2- hút nhau tạo thành liên kết trong phân tử calcium oxide.
Luyện tập 3 trang 36 SGK KHTN lớp 7 Cánh Diều
Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
Trả lời
- Phân tử potassium chloride là hợp chất ion được tạo bởi kim loại điển hình (K) và phi kim điển hình (Cl)
- Mà hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao
+ Khi tan trong nước tạo ra dung dịch dẫn được điện
⟹ Ở điều kiện thường, potassium chloride là chất rắn
Liên kết cộng hóa trị
Câu hỏi 6 trang 36 SGK KHTN lớp 7 Cánh Diều
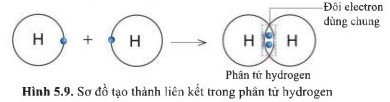
Quan sát hình 5.9, hãy cho biết nguyên tử H trong phân tử hydrogen có lớp vỏ tương tự khí hiếm nào.
Trả lời
Trong phân tử hydrogen gồm hai nguyên tử H, mỗi nguyên tử H có 2 electron ở lớp vỏ.
Tương tự với lớp vỏ của khí hiếm Helium
Luyện tập 4 trang 36 SGK KHTN lớp 7 Cánh Diều
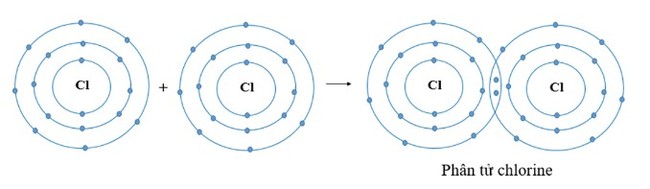
Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine.
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm?
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine.
Trả lời
a) Vì mỗi nguyên tử Cl đều có 7 electron ở lớp vỏ ngoài cùng ⟹ Cần nhận thêm 1 electron vào lớp vỏ ngoài cùng để có lớp vỏ tương tự khí hiếm
b)
- Vì mỗi nguyên tử Cl đều cần nhận thêm 1 electron
⟹ Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử sẽ góp 1 electron ở tạo ra đôi electron dùng chung
Câu hỏi 7 trang 37 SGK KHTN lớp 7 Cánh Diều
Quan sát hình 5.10, cho biết trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng.
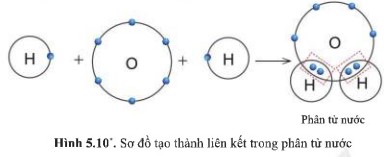
Trả lời
Trong phân tử nước, nguyên tử O có 8 electron lớp ngoài cùng tương tự như khí hiếm.
Mỗi nguyên tử H có 2 electron lớp ngoài cùng tương tự như khí hiếm helium
Luyện tập 5 trang 37 SGK KHTN lớp 7 Cánh Diều
Mỗi nguyên tử H kết hợp với một nguyên tử Cl tạo thành phân tử hydrogen chloride. Hãy vẽ sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và nguyên tử Cl.
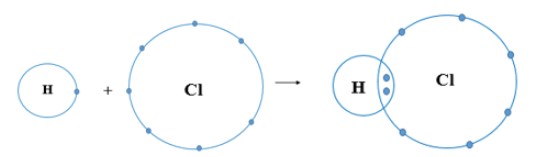
Trả lời
Nguyên tử H và nguyên tử Cl đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng
⟹ Nguyên tử H và Cl đều cần thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm
⟹ Khi H và Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung
⟹ Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và Cl:
Luyện tập 6 trang 37 SGK KHTN lớp 7 Cánh Diều
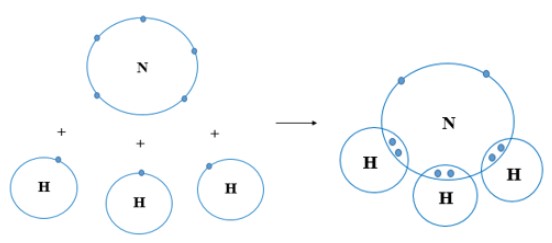
Mỗi nguyên tử N kết hợp với 3 nguyên tử H tạo thành phân tử ammonia. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử ammonia.
Trả lời
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi N kết hợp với H, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
Câu hỏi 8 trang 37 SGK KHTN lớp 7 Cánh Diều
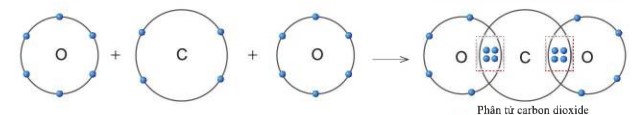
Quan sát hình 5.11, hãy cho biết trong phân tử khí carbonic nguyên tử C có bao nhiêu electron dùng chung với nguyên tử O.
Trả lời
Trong phân tử khí carbonic, nguyên tử C có 4 electron dùng chung với nguyên tử O (mỗi nguyên tử O góp 2 electron).
Luyện tập 7 trang 37 SGK KHTN lớp 7 Cánh Diều
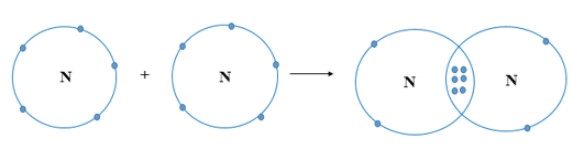
Hai nguyên tử N kết hợp với nhau tạo thành phân tử nitrogen. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử nitrogen.
Trả lời
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi hai nguyên tử N liên kết với nhau, mỗi nguyên tử góp chung 3 electron để tạo ra 3 cặp electron dùng chung. Hạt nhân của hai nguyên tử N cùng hút các đôi electron dùng chung và liên kết với nhau tạo thành phân tử nitrogen.
Vận dụng trang 38 SGK KHTN lớp 7 Cánh Diều
Hãy giải thích các hiện tượng sau:
a) Nước tinh khiết hầu như không dẫn điện, nhưng nước biển lại dẫn được điện.
b) Khi cho đường ăn vào chảo rồi đun nóng sẽ thấy đường ăn nhanh chóng chuyển từ thể rắn sang thể lỏng, làm như vậy với muối ăn thấy muối ăn vẫn ở thể rắn.
Trả lời
a)
- Nước là hợp chất cộng hóa trị giữa nguyên tử O và 2 nguyên tử H ⟹ Không dẫn điện
- Nước biển có thành phần chủ yếu là muối ăn (NaCl): đây là hợp chất ion được tạo bởi kim loại điển hình (Na) và phi kim điển hình (Cl) ⟹ Dẫn điện
b)
- Đường ăn là hợp chất cộng hóa trị giữa các nguyên tử C, H và O ⟹ Nhiệt độ nóng chảy thấp ⟹ Khi đun nóng nhanh chóng chuyển từ thể rắn sang thể lỏng
- Muối ăn là hợp chất ion được tạo bởi kim loại điển hình (Na) và phi kim điển hình (Cl) ⟹ Nhiệt độ nóng chảy cao ⟹ Khi đun nóng trên chảo muối ăn vẫn ở thể rắn
Câu hỏi 9 trang 38 SGK KHTN lớp 7 Cánh Diều
So sánh một số tính chất chung của chất cộng hóa trị với chất ion.
Trả lời
| Tính chất | Chất ion | Chất cộng hóa trị |
| Trạng thái (ở điều kiện thường) | Thể rắn | Cả ba thể (rắn, lỏng, khí) |
| Nhiệt độ sôi, nhiệt độ nóng chảy | Cao | Thấp |
| Dẫn điện | Tan trong nước tạo dung dịch dẫn điện | Nhiều chất không dẫn điện (đường ăn, ethanol,…) |
Chúc các em học tốt với tài liệu Giải khoa học tự nhiên 7 Cánh Diều trên đây!
