Đọc tài liệu xin gửi tới các em kiến thức có bản về bảng tuần hoàn các nguyên tố hóa học mà khi bắt đầu vào môn Hóa học lớp 8 chúng ta sẽ được làm quen ngay từ khi bắt đầu vào chương trình.
Bảng tuần hoàn các nguyên tố hóa học chính thức
Bảng tuần hoàn chính là một phương pháp liệt kê các nguyên tố hóa học thành bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
I. Các mẫu Bảng tuần hoàn
Cùng Đọc tài liệu xem có những bảng tuần hoàn nào nhé:
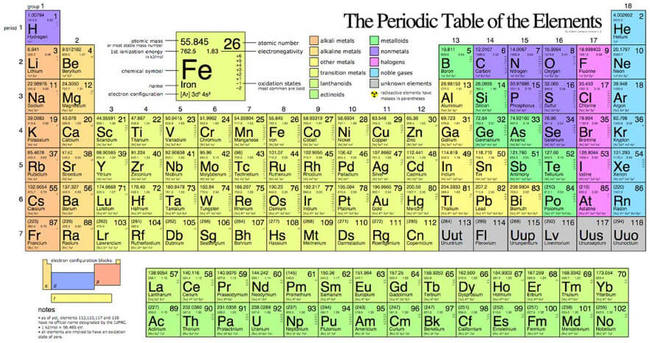
1. Bảng tuần hoàn các nguyên tố hóa học chính thức được sử dụng ở nhiều quốc gia trên thế giới:
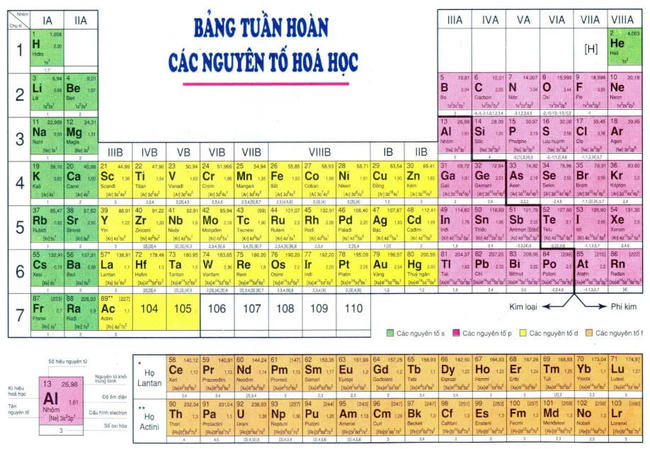
2. Bảng tuần hoàn các nguyên tố hóa học được sử dụng ở Việt Nam
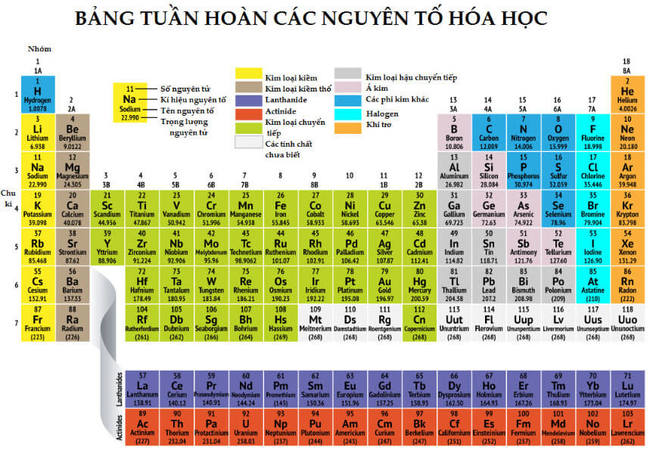
Bàng tuần hoàn đang được học sinh sử dụng nhiều nhất
3. Cẩm nang sử dụng bảng tuần hoàn các nguyên tố hóa học dành cho giáo viên và học sinh

Vậy là có rất nhiều mẫu bảng tuần hoàn mà em có thể lựa chọn để làm quen và phục vụ nhu cầu học tập của mình, với những em học sinh cho đội tuyển quốc gia thì việc làm quen bảng tuần hoàn quốc tế cũng là một việc học tập hữu ích nhé!
II. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron (e) trong nguyên tử được sắp xếp thành một hàng (từ trái qua phải + từ bé đến lớn).
- Các nguyên tố có số e hóa trị trong nguyên tử như nhau được xếp thành một cột (từ trên xuống dưới + từ bé đến lớn).
III. Cấu tạo của bảng tuần hoàn
1. Ô nguyên tố
- Tính tới hiện nay thì bảng tuần hoàn có 118 nguyên tố = 118 ô nguyên tố đã được xác nhận, bao gồm các nguyên tố từ 1 (hiđrô) tới 118 (oganesson) trong đó các nguyên tố 113, 115, 117 và 118 đã được tổng hợp trong phòng thí nghiệm
- Số thứ tự của ô nguyên tố = số đơn vị điện tích hạt nhân (Z) = số proton = số electron trong nguyên tử.
2. Chu kì (Bảng tuần hoàn các nguyên tố hóa học)
- Bảng tuần hoàn gồm có 7 chu kì và mỗi chu kì là dãy các nguyên tố của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần:
| STT | Nguyên tố bắt đầu | Nguyên tố kết thúc | Số nguyên tố |
|---|---|---|---|
| 1. | H (Z = 1): 1s1 | He (Z = 2): 1s2 | 2 |
| 2. | Li (Z = 3) | Ne (Z = 10) | 8 |
| 3. | Na (Z = 11) | Ar (Z = 18) | 8 |
| 4. | K (Z = 19) | Kr (Z = 36) | 18 |
| 5. | Rb (Z =37) | Xe (Z = 54) | 18 |
| 6. | Cs (Z = 55) | Rn (Z = 86) | 32 |
| 7. | Fr (Z = 87) | Chưa xác định | Chưa hoàn thiện |
- Số thứ tự của chu kì = số lớp e trong nguyên tử.
3. Loại nguyên tố (Bảng tuần hoàn các nguyên tố hóa học)
- Nguyên tử có 1, 2, 3 e ở lớp ngoài cùng: là nguyên tố kim loại (trừ H, He).
- Nguyên tử có 5, 6, 7 e ở lớp ngoài cùng: thường là nguyên tố phi kim.
- Nguyên tử có 8e ở lớp ngoài cùng: là nguyên tố khí hiếm (cả trường hợp He có 2e).
- Nguyên tử có 4e ở lớp ngoài cùng là phi kim nếu thuộc chu kì 2, 3 và là kim loại nếu thuộc các chu kì khác.
4. Nhóm nguyên tố (Bảng tuần hoàn các nguyên tố hóa học)
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình e tương tự nhau do đó có tính chất hóa học gần giống nhau và được xếp thành 1 cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+/ Nhóm A: bao gồm các nguyên tố s và p. Số thứ tự nhóm A = tổng số e lớp ngoài cùng
+/ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử thì tận cùng ở dạng (n – 1)dxnsy:
- Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
- Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
- Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
5. Khối nguyên tố (block) (Bảng tuần hoàn các nguyên tố hóa học)
Các nguyên tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d và khối f.
e cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
Lưu ý: nguyên tố H hiện nay được xếp ở hai vị trí là nhóm IA và VIIA đều ở chu kì I. Nguyên tố He mặc dù có 2e lớp ngoài cùng nhưng được xếp ở nhóm VIIIA. Điều này hoàn toàn phù hợp vì H giống kim loại kiềm đều có 1e ở lớp ngoài cùng nhưng nó cũng giống các halogen vì chỉ thiếu 1e nữa là đạt cấu hình bền giống khí hiếm He; còn He mặc dù có 2e ở lớp ngoài cùng nhưng giống các khí hiếm khác là cấu hình e đó là bão hoà.
-/-
Trong nghiên cứu, giảng dạy và học tập hoá học thì có thể nói bảng tuần hoàn (hay hệ thống tuần hoàn) các nguyên tố hoá học là một công cụ rất cần thiết. Có nhiều dạng bảng tuần hoàn khác nhau nhưng trong nội dung trên Đọc tài liệu đã cập nhật những thông tin mới nhất và chính thức được công bố. Mong rằng với nội dung kiến thức này sẽ giúp các em ghi nhớ tốt hơn về bảng tuần hoàn cũng như học thật tốt môn Hóa học nhé!
Cùng tìm hiểu thêm giải hóa 8 chi tiết theo chương trình học do Đọc tài liệu thực hiện!
