Propilen (propylen) C3H6 được ứng dụng nhiều trong cuộc sống và sản xuất công nghiệp. Hãy cùng Đọc tài liệu tìm hiểu về tính chất vật lý, tính chất hóa học và ứng dụng của chất khí công nghiệp quan trọng này qua bài viết dưới đây.
Khái quát về Propilen
Propilen (propylen) còn được gọi là propen hoặc methyl ethylen, là một hợp chất hữu cơ không bão hòa, không no mạch hở có công thức hóa học C3H6
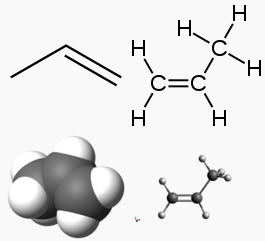
Nó có một liên kết đôi và là thành viên đơn giản thứ hai trong nhóm hydrocacbon anken sau etylen
Phân tử có một liên kết đôi và là chất có cấu tạo phân tử đơn giản thứ hai của lớp alkene của các hydrocacbon.
Tính chất vật lí của propilen
- Propylen là một chất khí không màu với mùi giống như dầu mỏ.
| Phân tử khối | 42,0797 đvC |
| Khối lượng riêng | 1.81(kg/m3) |
| Nhiệt độ nóng chảy | -185,2°C = 87,95 K = -301,36°F |
| Nhiệt độ sôi | -47,3°C = 226,15 K = -52,6°F |
- Propylen nhẹ hơn nước và tan rất ít trong nước 0.61 g/m3. Không hòa tan trong các dung môi phân cực như nước, chỉ tan trong dung môi không phân cực hay ít phân cực...
- Propilen không có tính dẫn điện.
- Nhận biết: Dẫn khí propen qua dung dịch brom màu da cam. Hiện tượng: Dung dịch brom bị mất màu.
Tính chất hóa học
1. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
Phản ứng cộng axit hoặc nước vào propilen thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
CH2=CH−CH3 \(\stackrel{\mathrm{+HCl}}{\rightarrow}\) CH3−CH−CH3 + CH2−CH2−CH3
| |
Cl Cl
(Sp chính) (Sp phụ)
CH3−CH=CH2 \(\stackrel{\mathrm{+H2SO4}}{\rightarrow}\) CH3−CH−CH3OH + H2O
*Lưu ý: nếu dùng nhiều H2SO4, sẽ tạo thành rượu bậc 2:
CH3−CH=CH2 + H2SO4 → (CH3)2CH−OSO3H
(CH3)2CH−OSO3H + H2O → (CH3)2CH−OH + H2SO4
- Phản ứng cộng halogen
CH3CH=CH2 +Br2 \(\stackrel{\mathrm{CCl}_{4}}{\rightarrow}\) CH3CHBrCH2Br
CH3CH=CH2 + Cl2 → CH3CHClCH2Cl
- Phản ứng cộng BH3 (axit lewis)
Axit lewis là một muối kim loại hóa trị 3 có thể tiếp nhận một cặp điện tử và tạo ra liên kết cộng hóa trị phối hợp. Thường dùng là nhôm clorua, sắt(III) clorua, triflorua bo và ytecbi(III) triflo.
CH3−CH=CH2 CH3−CH2−CH2−OH
2. Phản ứng trùng hợp
- Propilen trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
nCH2=CH \( \stackrel{\mathrm{t}^{0}, \mathrm{xt}}{\longrightarrow}\) (−CH−CH−)n
| |
CH3 CH3
3. Phản ứng hydro hóa
\(\mathrm{C}_{3} \mathrm{H}_{6}+\mathrm{H}_{2} \stackrel{\mathrm{Ni} / \mathrm{Pd} / \mathrm{Pt}}{\rightarrow} \mathrm{C}_{3} \mathrm{H}_{8}\)
4. Phản ứng oxi hóa
- Propilen làm mất màu dung dịch KMnO4:
3C3H6 + 2KMnO4 + 4H2O → 2KOH + 2MnO2 + 3C3H6(OH)2
→ Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
- Oxy hóa bằng dung dịch KMnO4 , K2Cr2O7 đậm đặc, nhiệt độ cao:
10C3H6 + 12KMnO4 + 18H2SO4 → 15CH3COOH + 1H2O + 12MnSO4 + 6K2SO4
3C3H6 + 5K2Cr2O7 + 20H2SO4 → 3CH3COOH + 3CO2 + 5Cr2(SO4)3 + 5K2SO4 + 23H2O
5. Phản ứng cháy
- Propen cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C3H6 + 9O2 → 3CO2 + 3H2O
Khi không đủ oxy để đốt cháy hoàn toàn, quá trình đốt cháy không hoàn toàn xảy ra và khi đó carbon monoxide và bồ hóng ( carbon ) cũng được hình thành.
C3H6 +2O2 → 3H2O + 2C + CO
Điều chế propilen
- Tách nước từ ancol
\(\mathrm{CH}{3} \mathrm{CH}{2} \mathrm{CH}{2} \mathrm{OH} \stackrel{\mathrm{H}{2} \mathrm{SO}{4}, 170^{\circ} \mathrm{C}}{\rightarrow} \mathrm{CH}{3} \mathrm{CH}=\mathrm{CH}{2}+\mathrm{H}{2} \mathrm{O}\)
- Tách HX từ dẫn xuất của halogen
C3H7Cl + NaOH → C3H6 + NaCl + H2O
- Khử dẫn xuất 2 lần thế của halogen
\(\mathrm{CH}{3} \mathrm{CHBrCH}{2} \mathrm{Br}+\mathrm{Zn} \stackrel{\mathrm{t}^{o}}{\rightarrow} \mathrm{CH}{3} \mathrm{CH}=\mathrm{CH}{2}+\mathrm{ZnBr}{2}\)
- Hydro hóa ankin
\(\mathrm{C}{3} \mathrm{H}{4}+\mathrm{H}{2} \stackrel{\mathrm{Pd} / \mathrm{PbCO} 3}{\longrightarrow} \mathrm{C}{3} \mathrm{H}{6}\)
- Nhiệt phân este
C3H7−O−COCH3 → C3H6 + CH3COOH
- Cracking butan
C4H10 → CH4 + C3H6
Ứng dụng propilen (propylen) trong thực tế
Propene là sản phẩm quan trọng xếp thứ hai trong ngành công nghiệp hóa dầu sau chất ethylene. Đây là nguyên liệu để sản xuất cho nhiều loại sản phẩm
Có ba loại propylene chính được sử dụng: lớp polymer với độ tinh khiết tối thiểu là 99,5%. Propylene hóa học có độ tinh khiết tối thiểu 93-94% và propylene dầu mỏ với độ tinh khiết khoảng 70%c (tối thiểu 60).
- Propylene cũng được sử dụng để sản xuất acrylonitrile (ACN), propilene oxide (PO), một số rượu, acid cumene và acrylic.
- Ứng dụng lớn nhất của Propylene được sử dụng trong các thiết bị điện và điện tử, đồ gia dụng, nắp chai, đồ chơi và hành lý.
- PP có thể được tìm thấy trong bao bì kẹo và thuốc lá, băng, nhãn, sợi PP được sử dụng trong thảm, quần áo và thay thế sisal và đay bằng dây thừng.
- PP có thể được ép đùn thành đường ống và ống dẫn, dây và cáp.
- Trong lĩnh vực ô tô, PP và các hợp kim của nó đã trở thành polymer của sự lựa chọn chiếm hơn một phần ba chất dẻo được sử dụng trong ô tô.
- Ứng dụng propylene lớn tiếp theo là propylen oxit: sử dụng bao gồm bọt linh hoạt cho đồ nội thất và ngành công nghiệp ô tô; bọt cứng cho thiết bị kết cấu cách nhiệt. PO cũng được sử dụng để sản xuất sơn, chất phủ, mực, nhựa và chất tẩy rửa.
- Một số ancol được làm từ propylen như Isopropanol (IPA) được sử dụng chủ yếu như một dung môi trong mỹ phẩm và các sản phẩm chăm sóc cá nhân, sơn và nhựa, dược phẩm, thực phẩm, mực in và chất kết dính.
~/~
Hy vọng với nội dung tổng hợp trên đây sẽ giúp các em hiểu rõ hơn về tính chất hóa học, tính chất vật lý và ứng dụng trong thực tế của Propilen. Chúc các em học tốt môn hóa!
