- Tính chất hóa học đặc trưng của các đơn chất halogen là gì?
- Nhóm halogen là gì?
- Vị trí của nhóm halogen trong bảng tuần hoàn
- Halogen có công thức là gì?
- Đặc điểm, tính chất chung của các nguyên tố Halogen
- Đặc điểm của các nguyên tố Halogen
- Tính chất vật lí của nhóm halogen
- Tính chất hóa học của nhóm halogen
- Nhận biết các dung dịch halogen
- Ứng dụng quan trọng của halogen
- Điều chế halogen
Tính chất hóa học đặc trưng của các đơn chất halogen là gì?
Mỗi nguyên tử nguyên tố halogen có số electron ở lớp ngoài cùng là 7 do đó nó có xu hướng nhận thêm 1 electron để đạt cấu hình bền vững của khí hiếm theo quy tắc octet khi hình thành liên kết hóa học. Vì vậy có thể kết luận tính chất hóa học đặc trưng của các đơn chất halogen là tính oxi hóa.Nhóm halogen là gì?
Nhóm halogen, hay còn gọi là các nguyên tố halogen là những nguyên tố thuộc nhóm VII A (tức nhóm nguyên tố thứ 17 theo danh pháp IUPAC hiện đại) trong bảng hệ thống tuần hoàn các nguyên tố hóa học. Nhóm nguyên tố halogen bao gồm các nguyên tố phi kim phản ứng tạo thành các hợp chất có tính axit mạnh với hiđro từ đó các muối đơn giản có thể được tạo ra.(Halogen trong tiếng Latinh nghĩa là sinh ra muối).
Vị trí của nhóm halogen trong bảng tuần hoàn
- Các nguyên tố halogen thuộc nhóm VIIA, chúng đứng gần cuối chu kì và ngay trước các nguyên tố khí hiếm.- Nhóm halogen gồm: Flo (F), Clo (Cl), Brom (Br), Iot (I), Atatin (At) (Atatin không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ).
Halogen có công thức là gì?
Các halogen ổn định tạo thành các phân tử hai nguyên tử thuộc cùng một nguyên tố. Do lực liên phân tử tương đối yếu, chlor và fluor tạo thành một phần của nhóm được gọi là "khí nguyên tố".Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5). Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
Công thức cấu tạo của halogen là X−X.
Công thức phân tử của halogen là: X2.
Đặc điểm, tính chất chung của các nguyên tố Halogen
Đặc điểm của các nguyên tố Halogen
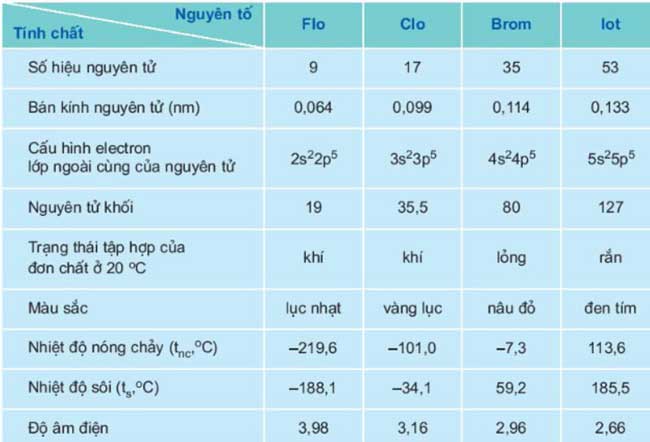
Bảng tổng hợp đặc điểm chung của các nguyên tố Halogen
Tính chất vật lí của nhóm halogen
- Trạng thái và màu sắc: Chuyển từ khí sang lỏng và rắn với màu sắc đậm dần, Flo ở dạng khí và có màu lục nhạt, Clo trạng thái khí có màu vàng lục, Brom dạng lỏng với màu đỏ nâu và Iốt ở trạng thái rắn có màu đen tím cùng dễ thăng hoa.- Nhiệt độ nóng chảy cùng nhiệt độ sôi tăng dần từ Flo đến Iot.
- Trong nhóm halogen ngoài Flo không tan trong nước, các chất còn lại tan tương đối ít và chủ yếu tan nhiều trong một số dung môi hữu cơ.
- Trong tự nhiên chỉ tồn tại ở dạng hợp chất: Clo chủ yếu ở dạng muối clorua, Flo thường ở trong khoáng vật florit và criolit, Brom chủ yếu trong muối bromua của kali, natri và magie, Iot có trong mô một số loại rong biển và tuyến giáp con người,...
- Độ âm điện: Giảm dần từ F đến I.
Tính chất hóa học của nhóm halogen
Tính chất hóa học đặc trưng của các đơn chất halogen là tính oxi hóa. Tính oxi hóa giảm dần theo chiều từ flo đến iốt.
Tác dụng với kim loạiCác nguyên tố thuộc nhóm halogen phản ứng hầu hết với các kim loại, ngoại trừ Au và Pt tạo ra muối halogenua và thường xảy ra ở nhiệt độ cao. Phản ứng thu được muối ứng với mức hóa trị cao nhất của kim loại, riêng phản ứng của Fe với I2 chỉ tạo sản phẩm là FeI2.
2M + nX2 → 2MXn
Phản ứng với hiđro tạo thành hiđro halogenua
H2 + X2 → 2HX
Điều kiện để các halogen tham gia phản ứng cộng H2 là:
- F2: phản ứng được ngay cả trong bóng tối.
- Cl2: phản ứng khi được chiếu sáng.
- Br2: phản ứng xảy ra khi được đun nóng ở nhiệt độ cao.
- I2: phản ứng có tính thuận nghịch và phải được đun nóng.
Tác dụng với nước
- F2 phản ứng mãnh liệt với nước giải phóng oxy: 2H2O + 2F2 → 4HF + O2
- Br2 và Cl2 có phản ứng thuận nghịch với nước: H2O + Cl2 ↔ HCl + HClO
- I2 không phản ứng với nước.
Phản ứng với dung dịch kiềm
- Dung dịch kiềm loãng nguội: X2 + 2NaOH → NaX + NaXO + H2O
(Riêng F2 : 2F2 + 2NaOH → 2NaF + H2O + OF2)
- Dung dịch kiềm đặc nóng: (3X2 + 6KOH → 5KX + KXO3 + 3H2O)
Tác dụng với dung dịch muối halogenua của halogen có tính oxi hóa yếu hơn
- X2 + 2NaX’ → 2NaX + X’2
(F2 không có phản ứng này, X’ là halogen có tính oxy hóa yếu hơn tính oxy hóa của halogen X)
- Các cặp oxi hóa - khử của halogen được xếp theo chiều giảm dần tính khử của các ion X- : I2/2I- , Br2/2Br- , Cl2/2Cl-
Nhận biết các dung dịch halogen
Dùng dung dịch AgNO3, dung dịch fluorua không tác dụng; dung dịch chloride tạo kết tủa AgCl màu trắng; dung dịch bromide tạo ra kết tủa AgBr màu vàng nhạt còn dung dịch iodide tạo ra kết tủa AgI màu vàng.
Ứng dụng quan trọng của halogen
- Cả chlor và brom đều được sử dụng làm chất tẩy uế cho nước uống, bể bơi, vết thương, spa, làm sạch bát đĩa và bề mặt.- Dùng trong tẩy trắng vải, sợi, giấy.
- Sử dụng trong công nghiệp sản xuất nhiên liệu hạt nhân.
- Brôm là nguyên liệu trong dược phẩm, thuốc nhuộm,..
- Dùng trong chế tạo AgBr trong ngành nhiếp ảnh.
- Là nguyên liệu tạo ra muối iot.
- Trong tên lửa: ứng dụng làm chất oxi hóa cho nhiên liệu lỏng.
Điều chế halogen
Điện phân muối halogenua
- Điện phân nóng chảy: 2MXn → 2M + nX2 (M là kim loại kiềm: Na, K; X thường là: Cl, Br, I).
- Điện phân dung dịch muối halogenua của kim loại kiềm có màng ngăn: 2NaCl + 2H2O → H2 + 2NaOH + Cl2
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
KClO3 + 6HCl → 3H2O + KCl + 3Cl2