Phân tích thí nghiệm của dung dịch X với NaOH
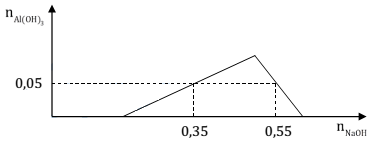
Tại $\left\{ \begin{array}{l}
{n_{NaOH}} = \,0,35\,mol\,\\
{n_{Al{{(OH)}_3}}} = \,0,05\,mol
\end{array} \right.$
→ ${n_{Al{{(OH)}_3}}} = \,\frac{{{n_{O{H^ - }}}\, - \,{n_{{H^ + }}}}}{3} \to \,0,05 = \,\frac{{0,35 - {n_{{H^ + }}}}}{3}$
→ ${n_{{H^ + }}} = $ 0,2 mol → x = 0,2 mol
Tại $\left\{ \begin{array}{l}
{n_{NaOH}} = \,0,55\,mol\,\\
{n_{Al{{(OH)}_3}}} = \,0,05\,mol
\end{array} \right.$
→ ${n_{Al{{(OH)}_3}}} = \,4{n_{A{l^{3 + }}}} - \,({n_{O{H^ - }}} - \,{n_{{H^ + }}})$ → 0,05 = 4${n_{A{l^{3 + }}}}$ - (0,55- 0,2) → ${n_{A{l^{3 + }}}} = $ 0,1 mol
Như vậy dung dịch X gồm có: $\left\{ \begin{array}{l}
{H^ + }:\,0,2mol\\
A{l^{3 + }}:\,0,1\,mol\,\\
C{l^ - }:\,0,1\,mol\\
SO_4^{2 - }:\,z\,mol
\end{array} \right.$ → bảo toàn điện tích → z = 0,2 mol
Thí nghiệm 2: ${n_{Ba{{(OH)}_2}}} = \,0,27mol$ (chú ý dung dịch X có ${H^ + }$ , và ${H^ + }\, + \,O{H^ - }$ )
→ $T\, = \,\frac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \,\frac{{0,27.2 - 0,2}}{{0,1}} = 3,4$ → kết tủa $Al{(OH)_3}$ bị hòa tan 1 phần
→${n_{Al{{(OH)}_3}}} = \,4{n_{A{l^{3 + }}}} - \,({n_{O{H^ - }}} - \,{n_{{H^ + }}})$= 4. 0,1 – (0,27.2-0,2) = 0,06 mol
→ ${m_{Al{{(OH)}_3}}} = $ 4,68 (g)
→ ${n_{BaS{O_4}}} = $ ${n_{SO_4^{2 - }}} = \,0,2\,mol$ → m = 46,6 (g)
→ m = 51,28(g)
Một dung dịch X có chứa các ion sau: x mol H + , y mol Al3 + , z mol
Xuất bản: 24/08/2020 - Cập nhật: 24/08/2020 - Tác giả: Chu Huyền
Câu Hỏi:
Một dung dịch X có chứa các ion sau: x mol ${H^ + }$ , y mol $A{l^{3 + }}$, z mol ${\rm{SO}}_{\rm{4}}^{{\rm{2 - }}}$ và 0,1 mol ${\rm{C}}{{\rm{l}}^{\rm{ - }}}$. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Cho 300 ml dung dịch $Ba{(OH)_2}$ 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là

Cho 300 ml dung dịch $Ba{(OH)_2}$ 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là
Câu hỏi trong đề: Đề ôn luyện thi THPT Quốc gia môn Hóa số 1 có đáp án
Đáp án và lời giải
đáp án đúng: C
