Khối lượng kết tủa Y là 47,4 g.
Trả lời:
Gọi số mol${H^ + },\,A{l^{3 + }},\,SO_4^{2 - }$trong mỗi phần là x, y, z
Tại A, khi nhỏ một lượng 0,3 mol NaOH, ta có:
0,3 = x + 0,05.3 → x = 0,15 mol
Áp vào điểm B, khi nhỏ một lượng 0,5 mol NaOH, ta có quá trình hòa tan khi kết tủa đạt cực đại xuống còn 0,05 mol kết tủa là: ${n_ \downarrow }\, = \,4{n_{A{l^{3 + }}}}\, - \,{n_{O{H^ - }}} = \,0,05$ mol (do trung hoà axit, ${n_{O{H^ - }}}$ dung cho kết tủa chỉ là: 0,5 – 0,15 = 0,35 mol)
→ 4.y = 0,35 + 0,05 → y = 0,1 mol
Bảo toàn điện tích suy ra dung dịch X gồm: $\left\{ \begin{array}{l}
{H^ + }\,\,\,0,15mol\\
A{l^{3 + }}\,\,\,0,1mol\\
SO_4^{2 - }\,\,\,0,2mol\\
C{l^ - }\,\,\,0,05mol
\end{array} \right.$
Khi nhỏ $Ba{(OH)_2}$ vào dung dịch X thì mất 0,075mol $Ba{(OH)_2}$trung hòa lượng ${H^ + }$, còn lại 0,105 mol $Ba{(OH)_2}$tác dụng với $A{l^{3 + }}$
Vậy ${n_{Al{{(OH)}_3}}}$ = 0,21 :3 = 0,07 mol
${m_ \downarrow }$ = 0,07.78 + 0,18,233 = 47,4 gam
Chia 1 lit dung dịch X có chứa các ion: H + , Al3 + , SO42 - và Cl - 0,1M,
Xuất bản: 17/09/2020 - Cập nhật: 17/09/2020 - Tác giả: Chu Huyền
Câu Hỏi:
Chia 1 lit dung dịch X có chứa các ion: $H^ + , Al^{3 +} , SO4^{2 -} và Cl^ -$ 0,1M, thành hai phần bằng nhau. Nhỏ từ từ đến dư dung dịch NaOH vào phần 1, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
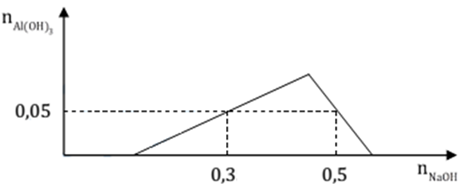
Mặt khác cho 300 ml dung dịch Ba(OH)2 0,6M tác dụng với phần 2, thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (biết các phản ứng xảy ra hoàn toàn)

Mặt khác cho 300 ml dung dịch Ba(OH)2 0,6M tác dụng với phần 2, thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (biết các phản ứng xảy ra hoàn toàn)
Câu hỏi trong đề: Đề ôn luyện thi THPT Quốc gia môn Hóa số 9 có đáp án
Đáp án và lời giải
đáp án đúng: C
