Cùng Đọc tài liệu tìm hiểu Lý thuyết về benzen và đồng đẳng, bài tập vận dụng qua nội dung bài viết dưới đây để tìm hiểu kỹ hơn về hydrocacbon thơm này.
Khái niệm về benzen
- Benzene là một hợp chất hữu cơ có công thức hoá học C6H6. Benzen là một hyđrocacbon thơm, trong điều kiện bình thường là một chất lỏng không màu, mùi dịu ngọt dễ chịu, dễ cháy. Benzen tan kém trong nước và rượu. Vì chỉ chứa carbon và hydro nên benzene là một hydrocarbon.
- Đồng đẳng của benzen bao gồm các hidrocacbon có 1 vòng benzen và nhánh no (gốc ankyl).
- Công thức chung dãy đồng đẳng của benzen: CnH2n-6 (n≥6)
Ví dụ: C6H6, C7H8
- Công thức phân tử benzen
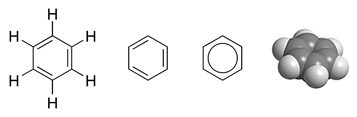
Benzen có công thức cấu tạo như sau: Phân tử benzen gồm 6 nguyên tử H và 6 nguyên tử C nằm trong cùng một mặt phẳng trong đó 6 nguyên tử C tạo thành hình lục giác đều, mỗi nguyên tử C lại liên kết với một nguyên tử H nữa. Độ dài các liên kết C-C bằng nhau, độ dài các liên kết C-H cũng như nhau.
Đồng phân
Từ C8H10 trở lên, tức n>8 bắt đầu xuất hiện đồng phân mạch cacbon, gồm có các gốc hidrocacbon biến đổi xung quanh vòng benzen.
Ví dụ: Etylbenzen có 3 đồng phân: C6H5 - CH2 - CH3, CH3 - C6H4 - CH3(o,m,p - xylen)
Danh pháp
Tên thông thường như: C6H5CH3 toluen
Tên thay thế: Gốc ankyl + benzen
Khi có 2 nhánh trở lên tên gọi sẽ bao gồm: Tên vị trí – tên nhánh + benzen
Ví dụ: C9H12 viết các đồng phân ankylbenzen, có 3 đồng phân vị trí ứng với công thức: CH3C6H4 - C2H5
Tính chất vật lý của benzen
Benzen là chất lỏng, không màu, ít tan trong nước, dễ cháy khi ở nhiệt độ thường. Benzen tan rất kém trong nước và rượu. Có khả năng cháy tạo ra khí CO₂ và nước, đặc biệt có sinh ra muội than.
Khối lượng mol: 78,1121 g/mol
Khối lượng riêng: 0,8786 g/cm³, chất lỏng
Điểm nóng chảy: 5,5 °C (278,6 K)
Điểm sôi: 80,1 °C (353,2 K)
Độ hòa tan trong nước: 1,79 g/L (25 °C)
Tính chất hóa học của benzen
1. Phản ứng cộng
- Cộng Hidro
Benzen trong điều kiện có xúc tác niken, nhiệt độ cao cộng với khí hydro tạo ra xiclohexan
- Cộng Clo
Khi có chiếu sáng, benzen tác dụng với khí clo tạo ra hexacloran C6H6Cl6 (còn gọi là thuốc trừ sâu ba số 6, thuốc trừ sâu 6-6-6)
2. Phản ứng thế
+) Phản ứng với halogen
Cho benzen và brom vào ống nghiệm khô rồi lắc nhẹ hỗn hợp.
Tiếp tục cho một ít bột sắt vào ống nghiệm chứa hỗn hợp trên, lắc nhẹ. Lúc này màu của brom nhạt dần và xuất hiện khí hidro bromua thoát ra (phản ứng thế).
+) Phản ứng với axit nitric
Cho benzen vào ống nghiệm chứa sẵn hỗn hợp H2SO4 đặc và HNO3 đặc. Lúc này sẽ xuất hiện lớp chất lỏng nặng màu vàng nhạt lắng xuống. Đó là nitrobenzen được tạo thành theo phản ứng như sau:
Nguyên tắc thế: Các ankylbenzen rất dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở các vị trí ortho và para so với nhóm ankyl.
Thế nguyên tử H của mạch nhánh :Nếu đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự như ankan.
C6H5CH3 + Cl2 → C6H5CH2Cl + HCl
+) Quy tắc thế ở vòng benzen
Khi vòng benzen đã có sắn nhóm ankyl (hay các nhóm –OH, -NH2, -OCH3,...
Phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí nhóm ortho và para. Ngược lại, nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, -SO3H, ...) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
| Dạng định hướng đồng phân | Nhóm thế tiêu biểu | Mức độ | Hoạt hóa/Phản hoạt hóa |
| Định hướng ortho, para | - OH, - NH2 (-NHR, -NR2) | Mạnh | Hoạt hóa |
| - OR | Trung bình | ||
| - NHC(R)=O | |||
| - OC(R)=O | |||
| - R, - Aren | |||
| - X (halogen) | Yếu | Phản hoạt hóa | |
| Định hướng meta | -C(R)=O, - CH=O | ||
| - COOH, - C(NH2)=O | |||
| - COOR | |||
| -SO3H, - CN, - CF3 | Trung bình | ||
| -NO2, -NR3, -SR3 | Mạnh |
3. Phản ứng Oxi hóa
Benzen không tác dụng được với KMnO4 chính vì thế mà chúng không làm mất màu dung dịch KMnO4. Benzen cũng rất dễ cháy và tạo ra khí cacbon đioxit và hơi nước. Phản ứng như sau:
C6H6 + O2 → 6CO2 + 3H2O
Trong trường hợp benzen cháy trong không khí thì chúng còn tạo ra muội than.
Điều chế Benzen
Cách phổ biến nhất để điều chế Benzen là chưng cất dầu mỏ và nhựa than đá. Ngoài ra, chúng cũng được điều chế từ ankan hoặc xicloankan. Công thức như sau:
CH3[CH2]4CH3 \( \stackrel{\mathrm{xt}, \mathrm{t}^{0},\mathrm{-4H}_{2}}{\longrightarrow} \) C6H6
Ứng dụng của Benzen
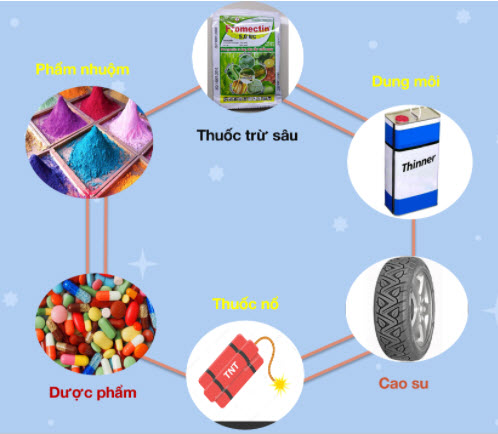
- Trong ngành công nghiệp, benzen được sử dụng rất phổ biến đặc biệt là ngành công nghiệp hóa hữu cơ. Bên cạnh đó, chúng cũng được dùng để tổng hợp các monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi.
- Benzen cũng thường được dùng để làm dung môi hoà tan các chất như mỡ, cao su, vecni. Dùng để tẩy mỡ ở xương, da sợi, vải, len, dạ, lau khô, tẩy mỡ các tấm kim loại. Bên cạnh đó các dụng cụ có bám bẩn chất mỡ cũng thường dùng benzen để tẩy.
- Benzen cũng là chất được dùng để điều chế ra các chất khác. Ví dụ như điều chế ra nitrobenzen, anilin, phenol, tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại, sản xuất cumen, axeton và phenol.
Bài tập về Benzen
Bài 1: Chất nào sau đây có khả năng tham gia phản ứng trùng hợp tạp polime?
A. benzen B. toluen C. 3 propan D. stiren
Bài 2: Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
A. benzen B. toluen C. propan D. stiren
Bài 3: Dãy các nhóm thế làm cho phản ứng thế vào vòng benzen dễ dàng hơn và ưu tiên vị trí o- và p- là:
A. CnH2n+1, -OH, -NH2 B. -OCH3, -NH2, -NO2
C. -CH3, -NH2, -COOH D. - NO2, -COOH, -SO3H
Bài 4: Benzen tác dụng với Br2 theo tỷ lệ mol 1 : 1 (có mặt bột Fe), thu được sẩn phẩm hữu cơ là
A.C6H6Br2 B. C6H6Br6
C. C6H5Br D. C6H6Br4
Bài 5: Phản ứng Benzen tác dụng với clo tạo C6H6Cl6 xảy ra trong điều kiện:
A. Có bột Fe xúc tác B. Có ánh sánh khuyếch tán
C. Có dung môi nước D. Có dung môi CCl4
Bài 6: Dãy gồm các nhóm thế làm cho phản ứng thế vào vòng benzen dễ dàng hơn và ưu tiên vị trí m- là:
A. -CnH2n+1, -OH, -NH2 B. –OCH3, -NH2, -NO2
C. –CH3, -NH2, -COOH D. –NO2, -COOH, -SO3H
Bài 7: Phản ứng nào sau đây không xảy ra:
A. Benzen + Cl2 (as) B. Benzen + H2 (Ni, tº)
C. Benzen + Br2 (dd) D. Benzen + HNO3 /H2SO4(đ)
Bài 8: Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A. Vậy A là:
A.C6H5Cl B.p-C6H4Cl2 C.C6H6Cl6 D.m-C6H4Cl2
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đ/a | D | D | A | C | B | D | C | C |
~/~
Hy vọng với nội dung tổng hợp trên đây sẽ giúp các em hiểu rõ hơn về Lý thuyết về benzen và đồng đẳng, bài tập vận dụng. Chúc các em học tốt môn hóa!
