Câu hỏi (Hóa học 10): Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.
Trả lời:
Natri clorua (NaCl) là một hợp chất ion, được tạo thành từ ion natri (Na+) và ion clorua (Cl-). Liên kết ion trong NaCl là lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Lực hút này có cường độ rất lớn, nhưng không có tính định hướng.
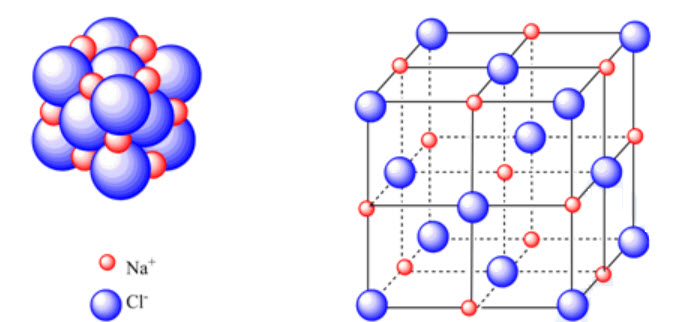
Tức là, một ion Na+ có thể hút nhiều ion Cl- xung quanh nó và ngược lại. Do đó, ở điều kiện thường, NaCl tồn tại dưới dạng tinh thể, trong đó các ion Na+ và Cl- được sắp xếp theo một trật tự xác định. Mỗi ion Na+ được bao quanh bởi sáu ion Cl- và mỗi ion Cl- được bao quanh bởi sáu ion Na+.
Vì vậy, ở điều kiện thường, không tồn tại các phân tử NaCl riêng biệt. Các phân tử NaCl chỉ tồn tại ở trạng thái khí ở nhiệt độ cao, khi lực hút tĩnh điện giữa các ion bị suy yếu.
Để minh họa cho điều này, ta có thể lấy ví dụ về muối ăn. Muối ăn là một dạng của NaCl. Khi muối ăn được hòa tan trong nước, các ion Na+ và Cl- sẽ tách ra khỏi tinh thể và phân tán trong nước. Ở trạng thái này, NaCl tồn tại dưới dạng dung dịch, trong đó các ion Na+ và Cl- di chuyển tự do. Tuy nhiên, khi nước bốc hơi, các ion Na+ và Cl- sẽ lại kết hợp với nhau tạo thành tinh thể NaCl.
Mặt khác, để tách các ion natri và clo ra khỏi mạng tinh thể NaCl, cần cung cấp một lượng năng lượng đủ lớn để phá vỡ liên kết ion. Điều này có thể thực hiện được bằng cách nung nóng NaCl ở nhiệt độ cao. Khi nhiệt độ tăng lên, các ion natri và clo bắt đầu chuyển động nhanh hơn và có thể tách rời khỏi nhau. Tuy nhiên, ngay cả khi nung nóng NaCl ở nhiệt độ cao, vẫn chỉ có một số ít các ion natri và clo tách rời khỏi mạng tinh thể. Phần lớn các ion vẫn tiếp tục liên kết với nhau dưới dạng mạng tinh thể.
Như vậy, có thể kết luận rằng, không tồn tại các phân tử NaCl riêng biệt ở điều kiện thường là do bản chất liên kết ion trong NaCl là lực hút tĩnh điện không có tính định hướng.
Trên dây là những nội dung sẽ giúp bạn hiểu rõ hơn để giải thích tại sao không tồn tại các phân tử NaCl riêng biệt ở điều kiện thường. Chúc các bạn học tốt!