Cùng Đọc tài liệu ôn luyện đề thi thử Hóa học vào 10 năm 2020 số 19 bao gồm 40 câu hỏi trắc nghiệm theo cấu chung đề tuyển sinh lớp 10.
Thử sức với đề thi này trong 45 phút em nhé!
Đề thi thử
Câu 1
Nồng độ khí CO₂ trong không khí tăng làm ảnh hưởng đến môi trường là do:
A. Là khí độc
B. Làm giảm lượng mưa
C. Tạo ra bụi
D. Gây hiệu ứng nhà kính
Câu 2
Cho các chất: N₂O₅ , NO, NO₂ , N₂O , N₂O₃ . Chất có thành phần phần trăm khối lượng của oxi nhỏ nhất là:
A. N₂O₅
B. NO
C. NO₂
D. N₂O
E. N₂O₃
Câu 3
Oxit nào sau đây giàu oxi nhất ?
A. Al₂O₃
B. N₂O₃
C. P₂O₅
D. Fe₃O₄
Câu 4:
Một oxit sắt trong đó oxi chiếm 30% khối lượng. Công thức của oxit sắt đó là:
A. FeO
B. Fe₂O₃
C. Fe₃O₄
D. Không xác định được
Câu 5:
Khử 4,64g hỗn hợp A gồm FeO, Fe₃O₄, Fe₂O₃ có số mol bằng nhau bằng CO thu được chất rắn B. Khí thoát ra sau phản ứng được dẫn vào dung dịch Ba(OH)₂ dư thu được 1,97g kết tủa. Khối lượng của chất rắn B là:
A. 4,4g
B. 4,84g
C. 4,48g
D. 4,45g
Câu 6:
Khử 4,64g hỗn hợp A gồm FeO, Fe₃O₄, Fe₂O₃ có số mol bằng nhau bằng CO thu được chất rắn. Hòa tan hoàn toàn B trong dung dịch HNO₃ thu được 2 khí NO và NO₂ có tỉ lệ mol 1 : 1. Tổng thể tích của 2 khí này là:
A. 0,1523 lít
B. 0,1269 lít
C. 0,1692 lít
D. 0,1629 lít
Câu 7
Oxi hóa hoàn toàn 14,3g hỗn hợp bột các kim loại Mg, Al, Zn bằng oxi thu được 22,3g hỗn hợp oxit. Cho lượng oxit này tác dụng hết với dung dịch HCl thì khối lượng muối tạo ra là:
A. 36,6 g
B. 32,05 g
C. 49,8 g
D. 48,9 g
Câu 8
Cho 12,2g hỗn hợp 2 muối cacbonat của kim loại kiềm ở 2 chu kì liên tiếp tác dụng hết với dung dịch HCl, thu được 2,24 lít khí (đktc). Khối lượng muối tạo ra sau phản ứng là:
A. 2,66 g
B. 13,3 g
C. 1,33 g
D. 26,6 g
Câu 9
Chọn các phương án đúng?
A. Fe có thể tan trong dung dịch FeCl₃
B. Ag có thể tan trong dung dịch FeCl₃
C. Cu có thể tan trong dung dịch PbCl₂
D. Cu có thể tan trong dung dịch FeCl₂
E. Fe có thể tan trong dung dịch CuCl₂
Câu 10
Để bảo quản dung dịch FeSO₄ trong phong thí nghiệm người ta ngâm vào dung dịch đó một đinh sắt đã làm sạch. Chọn cách giải thích đúng cho việc làm trên:
A. Để Fe tác dụng hết với H₂SO₄ dư khi điều chế FeSO₄ bằng phản ứng:
Fe + H₂SO₄ loãng --> FeSO₄ + H₂
B. Để Fe tác dụng với các tạp chất trong dung dịch. Chẳng hạn với tạp chất là CuSO₄
Fe + CuSO₄ --> FeSO₄ + Cu
C. Để sắt tác dụng hết với O₂ hòa tan:
2 Fe + O₂ --> 2 FeO
D. Để Fe khử muối sắt (III) xuống muối sắt (II):
Fe + Fe₂(SO₄)₃ --> 3FeSO₄
Câu 11
Chất A là một gluxit có phản ứng thủy phân
A + H₂O \(\overset {axit} \rightarrow\) 2B
A Có CTPT nào ?
A. C₆H₁₂O₆
B. \({( - {C_6}{H_{10}}{O_5} - )_n}\)
C. C₁₂H₂₂O₁₁
D. Không xác định được
Câu 12
Muốn có 2631,5 g glucozơ thì khối lượng saccarozơ cần đem thủy phân là:
A. 4486,85 g
B. 4468,85 g
C. 4486,58 g
D. 4648,85 g
Câu 13
Thuốc thử nào sau đây có thể phân biệt được dung dịch saccarozơ và dung dịch glucozơ
A. Dung dịch H₂SO₄ loãng
B. Dung dịch NaOH
C. Dung dịch AgNO₃ trong amoniac
D. Tất cả các dung dịch trên
Câu 14
Saccarozơ có thể tác dụng với chất nào sau đây?
A. H₂ ( xúc tác Ni, t⁰)
B. Dung dịch AgNO₃ trong amoniac
C. Cu(OH)₂
D. Tất cả các chất trên
Câu 15
Thủy phân 1 kg saccarozơ trong môi trường axit với hiệu suất 76%. Khối lượng các sản phẩm thu được là:
A. 0,4 kg glucozơ và 0,4 kg fructozơ
B. 0,5 kg glucozơ và 0,5 kg fructozơ
C. 0,6 kg glucozơ và 0,6 kg fructozơ
D. Kết quả khác
Câu 16
Một nhà máy đường mỗi ngày ép 30 tấn mía. Biết 1 tạ mía cho 63 lít nước mía nồng độ đường 7,5 % và khối lượng riêng 1,103 g/ml. Khối lượng đường thu được là:
A. 1613,1 kg
B. 1163,1 kg
C. 1631,1 kg
D. 1361,1 kg
Câu 17
Trong thành phần chất protein ngoài các nguyên tố C, H, O thì nhất thiết phải có nguyên tố nào dưới đây?
A. Photpho
B. Lưu huỳnh
C. Nitơ
D. Sắt
Câu 18
Để giặt áo bằng len lông cừu cần dùng loại xà phòng có tính chất nào dưới đây?
A. Xà phòng có tính bazơ
B. Xà phòng có tính axit
C. Xà phòng trung tính
D. Loại nào cũng được
Câu 19
Phân biệt dung dịch CaCl₂ và dung dịch MgCl₂ bằng:
A. Dung dịch NaOH
B. Dung dịch Mg(OH)₂
C. Dung dịch Cu(NO₃)₂
D. Dung dịch ZnSO₄
Câu 20
Cho 12,7 g muối sắt clorua vào dung dịch NaOH có dư trong bình kín thu được 9g một chất kết tủ
A. Công thức hóa học của muối sắt là:
A. FeCl₃
B. FeCl₂
C. FeCl
D. Fe₂Cl₃
Câu 21
Nếu chỉ dùng dung dịch KOH thì có thể phân biệt được 2 muối trong mỗi cặp chất sau đây không
A. Dung dịch K2SO₄ và dung dịch Fe₂(SO₄)₃
B. Dung dịch K2SO₄ và dung dịch K2CO₃
C. Dung dịch K2SO₄ và dung dịch BaCl₂
D. Dung dịch K2SO₄ và dung dịch KCl
Câu 22
Có thể dùng dung dịch nào sau đây để phân biệt được 2 dung dịch bazơ: NaOH và Ca(OH)₂
A. Dung dịch BaCl₂
B. Dung dịch K2CO₃
C. Dung dịch HCl
D. Cả 3 đáp án trên
Câu 23
Cho 3,04 g hỗn hợp NaOH và KOH tác dụng vừa đủ với dung dịch HCl, thu được 4,15g các muối clorua. Khối lượng của mỗi hiđroxit trong hỗn hợp đầu lần lượt là:
A. 2,24 g và 0, 8 g
B. 2,51 g và 0,53 g
C. 2,11 g và 0,93 g
D. 0,8 g và 2,24 g
Câu 24
Trộn 30 ml dung dịch có chứa 2,22 g CaCl₂ với 70 ml dung dịch có chứa 1,7 g AgNO₃
Khối lượng chất rắn sinh ra là:
A. 2,87 g
B. 1,435 g
C. 1,35 g
D. 2,52 g
Câu 25
Trộn 30 ml dung dịch có chứa 2,22 g CaCl₂ với 70 ml dung dịch có chứa 1,7 g AgNO₃
Nồng độ mol của chất còn lại trong dung dịch sau phản ứng lần lượt là:
A. 0,05 M và 0,15 M
B. 0,15 M và 0,05 M
C. 0,1 M và 0,1 M
D. 0,12 M và 0,06 M
Câu 26
Nếu chỉ dùng dung dịch NaOH thì em không thể phân biệt được 2 muối trong mỗi cặp chất nào sau:
A. Dung dịch Na₂SO₄ và dung dịch Fe₂(SO₄)₃
B. Dung dịch Na₂SO₄ và dung dịch CuSO₄
C. Dung dịch Na₂SO₄ và dung dịch BaCl₂
D. Cả 3 cặp trên
Câu 27
Biết 5g hỗn hợp muối là CaCO₃ và CaSO₄ tác dụng vừa đủ với 200 ml dung dịch HCl, sinh ra được 448 ml khí ( điều kiện tiêu chuẩn)
Nồng độ mol của dung dịch HCl đã dùng:
A. 0,4 M
B. 0,2 M
C. 0,3 M
D. 0,1 M
Câu 28
Biết 1 mol khí etilen cháy hoàn toàn tỏa ra một nhiệt lượng là 1423 kJ. Nhiệt lượng tỏa ra khi đốt cháy 1 kg etilen là:
A. 50821,4 kJ
B. 50281,4 kJ
C. 50128,4 kJ
D. 50812,4 kJ
Câu 29
1. K2O và CO₂
2. NaOH và SO₂
3. K2O và H₂O
4. CaO và CO₂
5. P₂O₅ và H₂O
6. Fe₂O₃ và H₂O
7. CO và K2O
Hãy cho biết những cặp trên, cặp nào tác dụng với nhau
A. 1, 2, 4, 5, 6
B. 2, 3, 4, 6, 7
C. 1, 3, 4, 5, 6
D. 1, 2, 3, 4, 5
Câu 30
Có 3 lọ mất nhãn đựng riêng biệt 3 khí: oxi, hiđro và khí CO₂ . Chọn phương pháp hóa học để nhận ra các khí trên:
A. Dùng dung dịch KOH và khí O₂
B. Dùng dung dịch Ba(OH)₂ và dung dịch H₂S
C. Dùng dung dịch Ca(OH)₂ và tàn đóm đỏ
D. Cả 3 phương án trên
Câu 31
Cần bao nhiêu gam Na₂SO₃ cho vào nước để điều chế 5 lít dung dịch có nồng độ 8% (D = 1,075 g/ml) ?
A. 430 g
B. 410 g
C. 415 g
D. 200 g
Câu 32
Cho 24g hỗn hợp CuO và Fe₂O₃ hòa tan vừa đủ vào 146g dung dịch HCl 20%. Khối lượng mỗi oxit trong hỗn hợp đầu lần lượt là:
A. 16g và 8g
B. 10g và 14g
C. 14g và 10g
D. 8g và 16g
Câu 33
Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi:
Chọn trường hợp đúng
A. Vừa đủ
B. Thiếu
C. Dư
Câu 34
Khi quạt gió vào bếp củi vừa bị tắt, lửa sẽ bùng cháy đỏ:
A. Lượng oxi giảm
B. Lượng oxi tăng
Câu 35
Biết 1 mol khí etilen cháy hoàn toàn tỏa ra một nhiệt lượng là 1423 KJ, còn 1 mol khí axetilen khi cháy tỏa ra 1320 KJ. Tính nhiệt lượng tỏa ra khi đốt cháy 1 kg etilen, 1 kg axetilen:
A. 50821,4 KJ và 52763,1 KJ
B. 50691,42 KJ và 50769,2 KJ
C. 42581,5 KJ và 36782 KJ
D. 50821,4 KJ và 50769,2 KJ
Câu 36
Cho 2 bình đựng 2 khí: CH₄ và C₂H₄ . Nêu phương pháp nhận biết 2 khí?
A. Dùng khí H₂
B. Dùng khí oxi
C. Dùng dung dịch Brom
D. Dùng khí oxi và H₂
Câu 37
Biết 0,01 mol hiđrocacbon X có thể tác dụng với tối đa với 100 ml dung dịch brom 0,1 M.
Vậy X là hiđrocacbon nào trong số các chất sau:
A. CH₄
B. C₂H₂
C. C₂H₄
D. C₆H₆
Câu 38
Những công thức nào sau là công thức cấu tạo của C₄H₁₀
A. CH₃ – CH₂ – CH₂ – CH₃
B. 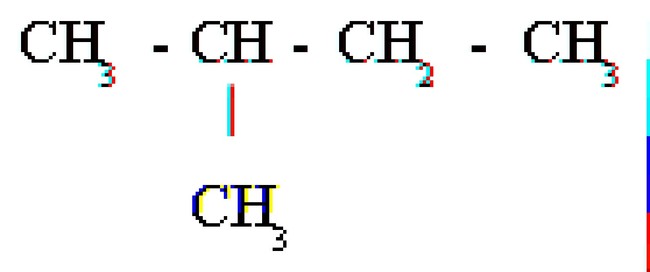
C. CH₃ – CH₂ – CH – CH₄
D. CH₂ – CH₃ – CH₂ – CH₃
Câu 39
Đốt cháy 3g chất hữu cơ A, thu được 8,8g khí CO₂ và 5,4g H₂O. Trong chất hữu cơ A chứa những nguyên tố nào:
A. C, H, O
B. C, H
C. C, H, N
D. C, H, Cl
Câu 40
Đốt cháy 28 mol hỗn hợp khí metan và axetilen cần phải dùng 67,2 ml khí oxi. Thành phần phần trăm mỗi khí trong hỗn hợp lần lượt là: (Các thể tích cháy đo ở cùng điều kiện)?
A. 20% và 80%
B. 25% và 75%
C. 22% và 78%
D. 60% và 40%
Nguồn tài liệu đề: Sưu tầm
Đáp án đề thi thử số 19 hóa học tuyển sinh vào 10
| Câu | Đáp án | Câu | Đáp án | Câu | Đáp án | Câu | Đáp án |
|---|---|---|---|---|---|---|---|
| 1 | D | 11 | C | 21 | A | 31 | A |
| 2 | D | 12 | A | 22 | B | 32 | D |
| 3 | B | 13 | C | 23 | D | 33 | A |
| 4 | B | 14 | C | 24 | B | 34 | B |
| 5 | C | 15 | A | 25 | B | 35 | D |
| 6 | D | 16 | A | 26 | C | 36 | C |
| 7 | C | 17 | C | 27 | B | 37 | C |
| 8 | B | 18 | C | 28 | A | 38 | A |
| 9 | A | 19 | A | 29 | D | 39 | B |
| 10 | D | 20 | B | 30 | C | 40 | A |
Cùng Đọc tài liệu thử sức các mẫu đề thi thử vào 10 tất cả các môn có hướng dẫn giải chi tiết để ôn thi tuyển sinh vào lớp 10 thật tốt!
